Thai FDA – TGA (Australia)
ความเป็นมา
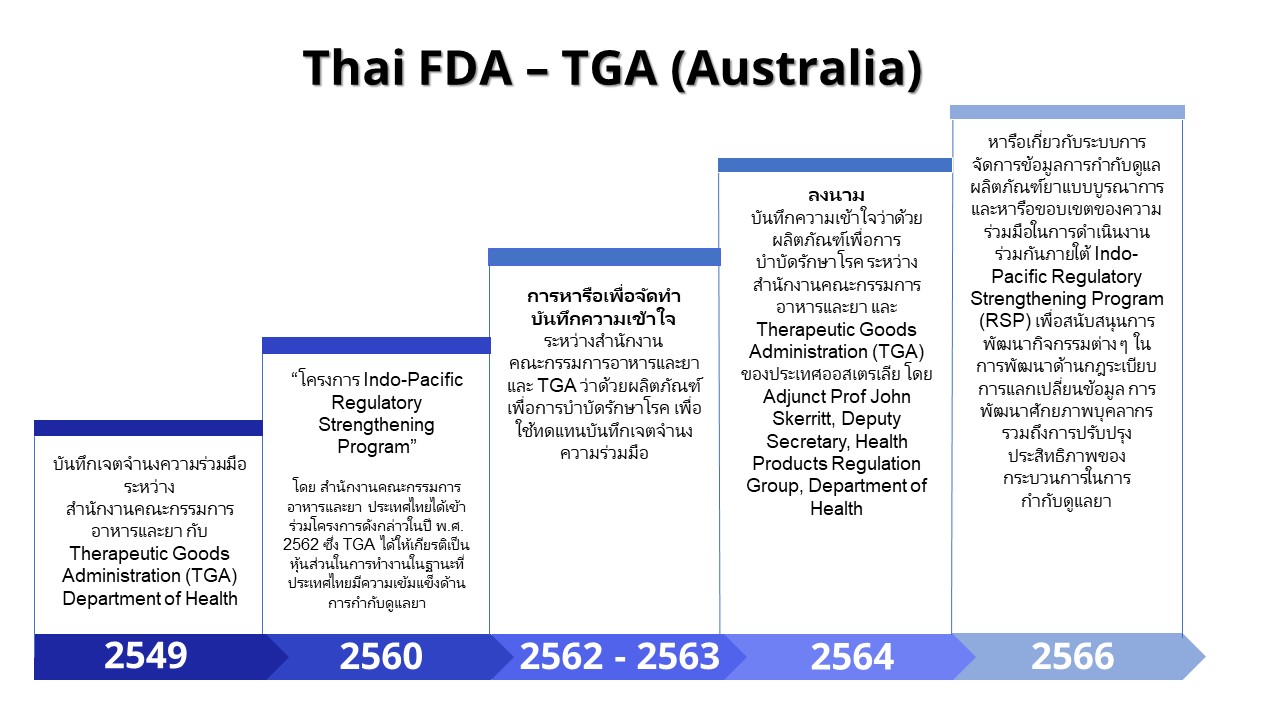
- สำนักงานคณะกรรมการอาหารและยา กระทรวงสาธารณสุข ราชอาณาจักรไทยกับ Therapeutic Goods Administration (TGA) Department of Health เครือรัฐออสเตรเลียมีบันทึกเจตจำนงความร่วมมือที่ลงนามเมื่อวันที่ 1 มีนาคม พ.ศ. 2549 โดยเป็นความร่วมมือด้านผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ซึ่งครอบคลุมผลิตภัณฑ์ยา และเครื่องมือแพทย์ มีขอบเขตของความร่วมมือ คือ การแลกเปลี่ยนข้อมูล และการฝึกอบรม
- ในปี พ.ศ. 2560 ความร่วมมือทางด้านวิชาการเพื่อสนับสนุนการกำจัดโรคติดเชื้อที่มีผลต่อสังคมและเศรษฐกิจในภูมิภาคถูกพัฒนาขึ้น โดยมีเป้าหมายเพื่อ เสริมสร้างความเข้มแข็งการกำกับดูแลผลิตภัณฑ์ด้านกฎระเบียบยา โดยเน้นการพัฒนาแนวทางเพื่อให้กระบวนการอนุญาตทะเบียนยามีความเข้มแข็ง มีประสิทธิภาพ เพื่อให้ผู้ป่วยสามารถเข้าถึงยาที่มีคุณภาพภายใต้ “โครงการ Indo-Pacific Regulatory Strengthening Program” ซึ่งเริ่มดำเนินการใน เดือน ตุลาคม 2017 มีระยะเวลาการดำเนินการ 5 ปี โดย The Australian Department of Health's Therapeutic Goods Administration (TGA) ร่วมกับThe Department of Foreign Affairs and Trade (DFAT) และประเทศที่เข้าร่วมโครงการมี 6 ประเทศ คือ ประเทศกัมพูชา ลาว อินโดนีเซีย พม่า เวียดนาม ปาปัวนิวกินี สำหรับสำนักงานคณะกรรมการอาหารและยา ประเทศไทยได้เข้าร่วมโครงการดังกล่าวในปี พ.ศ. 2562 ซึ่ง TGA ได้ให้เกียรติเป็นหุ้นส่วนในการทำงานในฐานะที่ประเทศไทยมีความเข้มแข็งด้านการกำกับดูแลยา (working closely with Thailand as a partner country, and collaborator with third country) และสนับสนุนให้ประเทศไทย เป็นพี่เลี้ยงในการให้ความรู้ ช่วยเหลือและแลเปลี่ยนประสบการณ์ในการกำกับดูแลยาตลอดวงจรให้แก่ประเทศอื่นๆ
- ในปี พ.ศ. 2562 และ พ.ศ. 2563 มีการหารือเพื่อจัดทำบันทึกความเข้าใจระหว่างสำนักงานคณะกรรมการอาหารและยา และ TGA ว่าด้วยผลิตภัณฑ์เพื่อการบำบัดรักษาโรค เพื่อใช้ทดแทนบันทึกเจตจำนงความร่วมมือที่ลงนามเมื่อวันที่ 1 มีนาคม พ.ศ.2549 และปรับให้เป็นปัจจุบันสอดคล้องกับบริบทที่เปลี่ยนแปลงไป โดยครอบคลุมการแลกเปลี่ยนข้อมูลที่เป็นชั้นความลับของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ได้แก่ ยา เครื่องมือแพทย์ วัตถุเสพติด และผลิตภัณฑ์สมุนไพร กิจกรรมความร่วมมือ รวมถึงการแลกเปลี่ยนบุคลากร การวิจัยร่วมกันที่เกี่ยวข้องกับคุณภาพ ความปลอดภัยหรือประสิทธิผลของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค หรือการประชุมร่วมที่เกี่ยวข้องกับกฎระเบียบของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค
- ในปี พ.ศ. 2564 Deputy Secretary, Health Products Regulation Group, Department of Health เครือรัฐออสเตรเลียได้ลงนามบันทึกความเข้าใจดังกล่าวเมื่อวันที่ 13 มกราคม พ.ศ. 2564 และเลขาธิการคณะกรรมการอาหารและยา ประเทศไทยได้ลงนามบันทึกความเข้าใจดังกล่าวเมื่อวันที่ 18 กุมภาพันธ์ พ.ศ. 2564
- มิถุนายน ปี พ.ศ. 2566 สำนักงานคณะกรรมการอาหารและยาได้ให้การต้อนรับผู้แทนจาก Therapeutic Goods Administration (TGA) เครือรัฐออสเตรเลีย เพื่อหารือเกี่ยวกับระบบการจัดการข้อมูลการกำกับดูแลผลิตภัณฑ์ยาแบบบูรณาการ และหารือขอบเขตของความร่วมมือในการดำเนินงานร่วมกันภายใต้ Indo-Pacific Regulatory Strengthening Program (RSP) เพื่อสนับสนุนการพัฒนากิจกรรมต่าง ๆ ในการพัฒนาด้านกฎระเบียบ การแลกเปลี่ยนข้อมูล การพัฒนาศักยภาพบุคลากร รวมถึงการปรับปรุงประสิทธิภาพของกระบวนการในการกำกับดูแลยา โดย TGA มีแผนการดำเนินการสนับสนุนการดำเนินงานร่วมกับ อย. ที่จะเกิดขึ้นในอนาคต อาทิ ระบบการยื่นเอกสารตำรับยาแผนปัจจุบันแบบอิเล็กทรอนิกส์ (ThaiRIM) เพื่อสนับสนุนผู้ประกอบการในการขึ้นทะเบียน และ การพัฒนาระบบการขึ้นทะเบียนตามระดับความเสี่ยง โดยให้มีการหาสมดุลระหว่างการคุ้มครองผู้บริโภคและการสนับสนุนอุตสาหกรรมยาให้สามารถดำเนินการไปด้วยกัน ซึ่งการประชุมในครั้งนี้นับเป็นโอกาสอันดีที่ได้หารือประเด็นความร่วมมือที่มีความสอดคล้องกับความต้องการของหน่วยงานและเป็นประโยชน์ต่อการพัฒนาระบบการทำงานของหน่วยงานในอนาคต
บันทึกความเข้าใจ
- บันทึกความเข้าใจว่าด้วยผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ระหว่างสำนักงานคณะกรรมการอาหารและยา และ Therapeutic Goods Administration (TGA) ของประเทศออสเตรเลีย โดย Adjunct Prof John Skerritt, Deputy Secretary, Health Products Regulation Group, Department of Health ออสเตรเลียได้ลงนามบันทึกความเข้าใจดังกล่าวเมื่อวันที่ 13 มกราคม พ.ศ. 2564 และเลขาธิการคณะกรรมการอาหารและยา ประเทศไทยได้ลงนามบันทึกความเข้าใจดังกล่าวเมื่อวันที่ 18 กุมภาพันธ์ พ.ศ. 2564 โดยมีผลบังคับใช้ตั้งแต่วันที่ลงนามเป็นต้นไป เว้นแต่คู่ภาคีตกลงที่จะยุติบันทึกความร่วมมือนี้ และครอบคลุมการแลกเปลี่ยนข้อมูลที่เป็นชั้นความลับของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ได้แก่ ยา เครื่องมือแพทย์ วัตถุเสพติด และผลิตภัณฑ์สมุนไพร กิจกรรมความร่วมมือ รวมถึงการแลกเปลี่ยนบุคลากร การวิจัยร่วมกันที่เกี่ยวข้องกับคุณภาพ ความปลอดภัยหรือประสิทธิผลของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค หรือการประชุมร่วมที่เกี่ยวข้องกับกฎระเบียบของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ซึ่งจะเป็นประโยชน์ต่อการพัฒนาศักยภาพของบุคลากรของสำนักงานฯ และเสริมสร้างความเข้มแข็งในการกำกับดูแลผลิตภัณฑ์เพื่อการบำบัดรักษาโรคของประเทศไทย
วัตถุประสงค์ของความร่วมมือ
- สนับสนุนการพัฒนากิจกรรมความร่วมมือที่เกี่ยวข้องกับกฎระเบียบของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค
- อำนวยความสะดวกในการแลกเปลี่ยนข้อมูลเกี่ยวกับกรอบกฎระเบียบการกำกับดูแลก่อนออกสู่ตลาด และหลังออกสู่ตลาดของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค รวมถึงข้อมูลเกี่ยวกับเอกสารคำแนะนำ นโยบาย วิธีปฏิบัติ มาตรฐาน วิธีการทดสอบและระบบสำหรับการติดตามและการรายงานเกี่ยวกับปัญหาความปลอดภัยที่อาจเกิดขึ้น รวมถึงอาการไม่พึงประสงค์
- อำนวยความสะดวกในการแลกเปลี่ยนข้อมูลและเอกสารที่เกี่ยวข้องกับกฎระเบียบของผลิตภัณฑ์เพื่อการบำบัดรักษาโรค
- อนุญาตให้ภาคีใช้ข้อมูลแลกเปลี่ยนและเอกสารประกอบในการปฏิบัติงานตามบทบาทหน้าที่ในการกำกับดูแลผลิตภัณฑ์
- ปรับปรุงประสิทธิภาพของกระบวนการกำกับดูแลและความปลอดภัยของผลิตภัณฑ์โดยอาศัยการมีส่วนร่วมของความเชี่ยวชาญในการกำกับดูแลผลิตภัณฑ์ของทั้งสองประเทศ
- เพิ่มความสามารถของคู่ภาคีในการปกป้อง ส่งเสริมสุขภาพและความปลอดภัยของประชากรในแต่ละประเทศ
- เสริมสร้างการสื่อสารระหว่างคู่ภาคี
ลำดับ | ชื่อไฟล์ | Downnload |
1. | บันทึกความเข้าใจว่าด้วยผลิตภัณฑ์เพื่อการบำบัดรักษาโรค ระหว่างสำนักงานคณะกรรมการอาหารและยา และ Therapeutic Goods Administration (TGA) ของประเทศออสเตรเลีย | |
2. | Exchange of Letters |


